下列物质的性质递变规律与化学键无关的是( )
A.还原性:Rb>K>Na>Li
B.沸点:CHI3>CHBr3>CHCl3>CHF3
C.硬度:金刚石>碳化硅>晶体硅
D.稳定性:H2O>H2S>H2Se>H2Te
试卷相关题目
- 1氮化铝(AlN)是一种熔点很高、硬度大、不导电、难溶于水和其他溶剂的晶体。将下列各组物质加热熔化或汽化,所克服粒子间的作用力与AlN克服粒子间的作用力都相同的是
A.水晶,金刚石
B.食盐,硫酸钾
C.碘,硫
D.石墨,硅
开始考试点击查看答案 - 2一带活塞的密闭容器中盛有
A.B组成的混合气体,从状态1自发反应到状态2的变化曲线如下图所示,则该反应过程〔A(g)+B(g)══2C(g)〕是()
 A.放热反应
A.放热反应B.吸热反应
C.对外界没有做功
D.内能不变
开始考试点击查看答案 - 3下列说法正确的是( )
A.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数
B.离子化合物中只有离子键,共价化合物中只有共价键
C.铵根离子呈正四面体结构
D.氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键
开始考试点击查看答案 - 4试判断下列物质能否溶于水,能溶于水的组合是( ) ①葡萄糖 ②己醛 ③硬脂酸 ④硬脂酸钠 ⑤硬脂酸镁 ⑥乙二酸 ⑦
 ⑧
⑧  ⑨
⑨  ⑩
⑩ 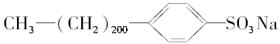
A.①④⑥⑦⑨
B.全溶
C.除⑤⑧外全溶
D.①④⑥⑦
开始考试点击查看答案 - 5下列两组热化学方程式中,有关△ H的比较正确的是( ) ① CH 4g)+2O 2(g) ====CO 2(g)+2H 2O(g);△ H 1 CH 4g)+2O 2(g) ====CO 2(g)+2H 2O(l);△ H 2 ② NaOH(aq) +H 2SO 4(浓)="===" Na 2SO 4(aq) +H 2O(l) ;△ H 3 NaOH(aq) + CH 3COOH (aq)="===" CH 3COONa (aq) +H 2O(l) ;△ H 4
A.△H1>△H2;△H3>△H4
B.△H1>△H2;△H3<△H4
C.△H1=△H2;△H3<△H4
D.△H1<△H2;△H3>△H4
开始考试点击查看答案 - 6下列叙述正确的是:
A.P4和CO2均由共价化合物分子构成
B.CCl4和NH4Cl中均存在共价键
C.Na2O和C60晶体中都不存在单个小分子
D.CH4分子是平面型分子,NH3分子的空间构型为三角锥形
开始考试点击查看答案 - 7通过复习总结,你认为下列对化学知识概括合理的是
A.金属离子只有氧化性,非金属离子只有还原性
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.原子晶体、离子品体、金属晶体、分子晶体中都一定存在化学键
D.在化学反应中,一定有化学键的断裂和形成,并伴有能量的变化
开始考试点击查看答案 - 8根据盖斯定律判断右图所示的物质转变过程中,正确的是
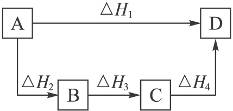
A.ΔH1=ΔH2=ΔH3=ΔH4
B.ΔH1+ΔH2=ΔH3+ΔH4
C.ΔH1+ΔH2+ΔH3=ΔH4
D.ΔH1=ΔH2+ΔH3+ΔH4
开始考试点击查看答案 - 9共价键、离子键、范德华力和氢键是形成晶体的微粒之间的四种作用力。下列晶体:①Na 2O 2②固态氨 ③NaCl ④SiO 2 ⑤冰 ⑥干冰,其中含有三种作用力的是
A.①②③
B.①②⑥
C.②⑤
D.⑤⑥
开始考试点击查看答案 - 10反应
 的能量变化如右图所示。下列说法正确的是
的能量变化如右图所示。下列说法正确的是 
A.12 g C(s)与一定量
 (g)反应生成14 g CO(g),放出的热量为110.5 kJ
(g)反应生成14 g CO(g),放出的热量为110.5 kJB.2 mol C(s)与足量
 (g)反应生成
(g)反应生成 (g),放出的热量大于221 kJ
(g),放出的热量大于221 kJC.该反应的热化学方程式是


D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与
开始考试点击查看答案 分子中化学键断裂时所吸收的总能量的差
分子中化学键断裂时所吸收的总能量的差
 湘公网安备:43011102000856号
湘公网安备:43011102000856号 
