- 讲师:刘萍萍 / 谢楠
- 课时:160h
- 价格 4580 元
特色双名师解密新课程高频考点,送国家电网教材讲义,助力一次通关
配套通关班送国网在线题库一套
 ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。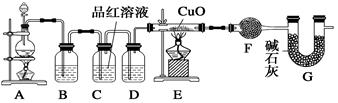
| A.两者都易溶于水 |
| B.两者都是有毒气体 |
| C.两者都能使品红溶液褪色 |
| D.两者都是形成酸雨的主要原因 |
责编:郝悦皓
| 课程专业名称 |
讲师 |
课时 |
查看课程 |
|---|
| 课程专业名称 |
讲师 |
课时 |
查看课程 |
|---|
点击加载更多评论>>