汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N
2(g)+O
2(g)
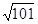
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10
-4。请回答:
(1)某温度下,向2L的密闭容器中充入N
2和O
2各1mol,5分钟后O
2的物质的量为0.5mol,则N
2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 |
B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
D.2v(N2)正=v(NO)逆 |
(3)将N
2、O
2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
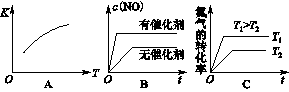
(4)向恒温恒容的密闭容器中充入等物质的量的N
2和O
2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N
2、O
2、NO的浓度分别为2.5×10
-1mol/L、4.0×10
-2mol/L和3.0×10
-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
答案 :
(1)0.05 mol/(L·min) (2)A、D (3)A、C; (4)不变;(5) 向正反应方向进行 因为浓度商Q
c<K
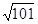 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
点击加载更多评论>>