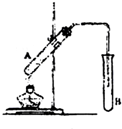
在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL乙醇,如图连接好装置进行实验,以制取乙酸乙酯.
(1)试管B中盛放的试剂是______;反应中浓硫酸的作用是______.
(2)乙醇与乙酸反应的化学方程式是______.
(3)B中的导管不能插入液面以下的原因是______.
(4)用30g乙酸与46g乙醇反应,如果实际产率是理论产率的60%,则可得到的乙酸乙酯的质量是______g.
答案 : (1)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质;浓硫酸在乙酸乙酯的制取中的作用为:吸水剂和催化剂,
故答案为:饱和碳酸钠溶液;吸水剂、催化剂;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为:CH
3COOH+CH
3CH
2OH
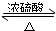
CH
3COOC
2H
5+H
2O,
故答案为:CH
3COOH+HOCH
2CH
3
CH
3COOCH
2CH
3+H
2O;
(3)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,加热不均匀易造成Na
2CO
3溶液倒流进加热反应物的试管中,导致试管破裂,所以B中的导管不能插入液面以下的原因是防止倒吸,
故答案为:防止倒吸;
(4)30g乙酸的物质的量为:30g÷60g/mol═0.5mol,46g乙醇的物质的量为:46g÷46g/mol═1mol,
根据方程式:CH
3COOH+HOCH
2CH
3
CH
3COOCH
2CH
3+H
2O
应按乙酸完全反应来计算理论产生乙酸乙酯的量为0.5mol,质量为0.5mol×88g/mol=44g,实际产量为0.44g×60%=26.4g,
故答案为:26.4.

 CH3COOC2H5+H2O,
CH3COOC2H5+H2O, CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O; CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
点击加载更多评论>>