某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.
(1)写出邻苯二甲酸氢钾与NaOH反应的化学方程式:______
(2)将用分析天平精确称量的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂______(从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是______.
(3)该实验要用到的主要玻璃仪器______(写二种)
(4)该学生进行三次实验,所取固体的质量均相同,填写下表:
| 实验编号 |
邻苯二甲酸氢钾的质量(g) |
待测NaOH溶液的体积(mL) |
| 1 |
0.4162 |
18.25 |
| 2 |
17.04 |
| 3 |
16.96 |
滴定中误差较大的是第______次实验,造成这种误差的可能原因是(只要写两种):
A.______
B.______
(5)NaOH溶液的物质的量浓度为______.
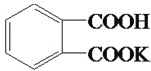
答案 : (1)邻苯二甲酸氢钾与NaOH生成邻苯二甲酸钠钾和水,其反应方程为:
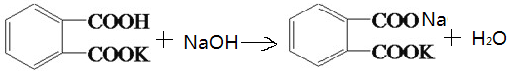
;
故答案为:
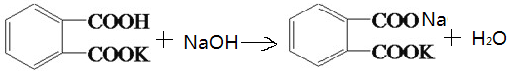
;
(2)邻苯二甲酸氢钾为弱酸,终点时溶液的pH约为9.1,滴定终点的pH要在指示剂的变色范围之内,所以选用酚酞作指示剂,酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:酚酞;无色溶液变成浅红色,且半分钟内不褪色;
(3)该实验要用碱式滴定管盛放氢氧化钠溶液,用锥形瓶盛放邻苯二甲酸氢钾,故主要玻璃仪器为:碱式滴定管、锥形瓶,
故答案为:碱式滴定管、锥形瓶;
(4)根据表中数据分析,第1次操作与另外两次数据差别较大;造成这种误差的可能原因是滴定时有NaOH溶液滴到锥形瓶外面或未用NaOH溶液润洗滴定管,故答案为:1;滴定时有NaOH溶液滴到锥形瓶外面、未用NaOH溶液润洗滴定管;
(5)邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等,
n(邻苯二甲酸氢钾)=
=0.00204mol,
V(NaOH)=
×10
-3=0.017L
所以氢氧化钠溶液物质的量浓度为c(NaOH)=
=0.12mol/L,
故答案为:0.12mol/L.

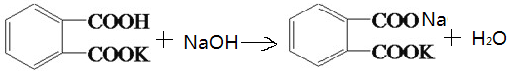 ;
;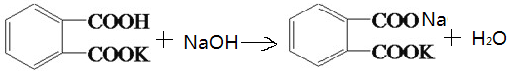 ;
;
点击加载更多评论>>