【题文】(16分)I.合成氨的原料气H
2可通过反应CO(g)+H
2O(g)

CO
2(g)+H
2(g)获取。
(1)T℃时,向容积固定为5L的容器中充入1mol水蒸气和1molCO,反应达平衡后,测得CO的浓度为0.08mol·L
-1,则平衡时CO的转化率为
,该温度下反应的平衡常数K值为
。
(2)保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是
(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成amolCO
2的同时消耗amolH
2d.混合气中n(CO):n(H
2O):n(CO
2):n(H
2)=1:16:6:6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH
3(g)+3O
2(g)=2N
2(g)+6H
2O(l) △H
1②4NH
3(g)+5O
2(g)=4NO(g)+6H
2O(l) △H
2③4NH
3(g)+6NO(g)=5N
2(g)+6H
2O(l) △H
3请写出上述三个反应中△H
1、△H
2、△H
3三者之间关系的表达式,△H
1=
。
(2)美国Simons等科学家发明了使NH
3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH
3+3O
2=2N
2+6H
2O
①写出该燃料电池的正极反应式
。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气
L。
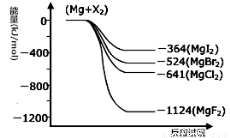
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为
(填“放热”或“吸热”)反应。
(2)金属Mg与CH
3Cl在一定条件下反应可生成CH
3MgCl,CH
3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH
3MgCl水解的化学方程式
。
答案 :
【答案】(16分)
I.(1)60%(2分) 2.25(2分) (2) c、d(2分)
II.(1)
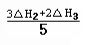
(2分);(2)①O
2+ 4e
-+ 2H
2O

4OH
- (2分) ② 2.24 (2分)
III.(1)放热 (2分)
(2)2CH
3MgCl+H
2O=2CH
4↑+Mg(OH)
2↓+MgCl
2或CH
3MgCl+H
2O=CH
4↑+Mg(OH)Cl↓(2分)
 CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
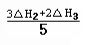 (2分);(2)①O2+ 4e-+ 2H2O
(2分);(2)①O2+ 4e-+ 2H2O 4OH- (2分) ② 2.24 (2分)
4OH- (2分) ② 2.24 (2分)
点击加载更多评论>>