碳、氮元素及其化合物与人类的生产生活密切相关.试回答下列有关问题:
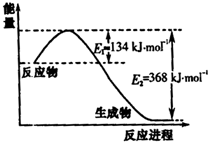
(1)下图是1molNO
2和1molCO反应生成CO
2和NO过程中能量变化示意图,请写出NO
2和CO反应的热化学方程式______.
(2)NH
3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol•L
-1的氨水,溶液中随着水量的增加而减小的是______(填序号).
A.
B.
C.c(H
+)•c(OH
-) D.
(3)标准状况下,将1.12LCO
2通入100mL1mol•L
-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为______;
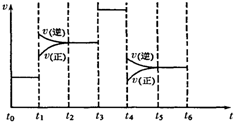
(4)在固定体积的密闭容器中,进行如下化学反应:N
2(g)+3H
2(g)⇌2NH
3(g).当反应达到平衡时不断改变条件(不改
变N
2、H
2和NH
3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中NH
3的含量最高的一段时间是______.
(5)甲烷燃料电池中发生的化学反应为:CH
4+2O
2=CO
2+2H
2O,该电池的电解质溶液为H
2SO
4溶液,写出其负极的电极反应式______.
答案 : (1)该反应的焓变△H=E
1-E
2=134KJ/mol-368KJ/mol=-234KJ/mol,
所以热化学方程式为NO
2(g)+CO(g)=CO
2(g)+NO(g)△H=-234kJ•mol
-1,
故答案为:NO
2(g)+CO(g)=CO
2(g)+NO(g)△H=-234kJ•mol
-1;
(2)A、当稀释氨水时,在水分子的作用下促进氨水的电离,所以氨根离子的浓度降低,K
电离=
,温度不变,电离平衡常数不变,故A错误;
B、因
=
,水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH
3.H
2O
OH
-+NH
4+可知,n(OH
-)增大,但溶液的体积增大的多,所以c(OH
-)减小,促进了氨水的电离,n(NH
3.H
2O)减少,c(NH
3.H
2O)减少,n(OH
-)增大,n(NH
3.H
2O)减少,所以比值变小,故B正确;
C、因温度不变,水的离子积K
W=c(H
+)•c(OH
-)不变,故C错误;
D、温度不变,水的离子积不变,当稀释氨水时,溶液中氢氧根的浓度减小,氢离子的浓度增加,所以
减小,故D正确;
故答案为:BD;
(3)由CO
2 +2NaOH═Na
2CO
3+H
2O
0.05mol0.1mol0.05mol
所以产物为0.05molNa
2CO
3,因CO
32-水解,溶液呈碱性,溶液呈碱性,则c(OH
-)>c(H
+),盐水解程度较小,则c(CO
32-)>c(OH
-),水中OH
-来源于CO
32-水解及水的电离,则(OH
-)>c(HCO
3-),水的电离程度很小c(HCO
3-)>c(H
+),所以c(Na
+)>c(CO
32-)>c(OH
-)>c(HCO
3-)>c(H
+),
故答案为:c(Na
+)>c(CO
32-)>c(OH
-)>c(HCO
3-)>c(H
+);
(4)由图2可知,t
1-t
2时应为升高温度使逆反应速率增大,化学平衡逆向移动,NH
3的含量减少;t
2-t
3时为平衡状态,含量不变;t
3-t
4时应为催化剂对化学反应的影响,反应速率增大,但化学平衡不移动;t
4-t
5时应为减小压强对反应的影响,减小压强化学平衡逆向移动,NH
3的含量减少,即t
0-t
1时NH
3的含量最大,故答案为:t
0-t
1;
(5)甲烷燃料电池中,正极的电极反应式为:O
2+4e
-+4H
+═2H
2O,总反应式减去正极反应式得负极反应式:CH
4+2H
2O-8e
-=CO
2+8H
+,故答案为:CH
4+2H
2O-8e
-=CO
2+8H
+;
临湘一中食堂以前烧煤,经过改造现在烧天然气,使校园环境有了很大的改善.天然气的主要成分是甲烷,若2克甲烷完全燃烧可放出QKJ的热量,请写出能表示甲烷燃烧热的热化学方程式______.
答案 : 2g甲烷完全燃烧生成液态水时放出QkJ热量,1mol甲烷16g燃烧发生反应放热8QkJ;反应的热化学方程式为:CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l)△H=-8QkJ/mol;
故答案为:CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l)△H=-8QkJ/mol;


 OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,所以c(OH-)减小,促进了氨水的电离,n(NH3.H2O)减少,c(NH3.H2O)减少,n(OH-)增大,n(NH3.H2O)减少,所以比值变小,故B正确;
OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,所以c(OH-)减小,促进了氨水的电离,n(NH3.H2O)减少,c(NH3.H2O)减少,n(OH-)增大,n(NH3.H2O)减少,所以比值变小,故B正确;
点击加载更多评论>>