能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
I.已知:Fe
2O
3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ•mol
-1CO(g)+1/2O
2(g)=CO
2(g)△H=bkJ•mol
-1C(石墨)+O
2(g)=CO
2(g)△H=ckJ•mol
-1则反应:4Fe(s)+3O
2(g)=2Fe
2O
3(s)的焓变△H=______kJ•mol
-1.
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是______(填序号).
A.C(s)+CO
2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H
2O(l)
C.2H
2O(l)=2H
2(g)+O
2(g)
D.CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应.
负极:______,
正极:______.
(2)二氧化氯(ClO
2)是一种高效安全的自来水消毒剂.ClO
2是一种黄绿色气体,易溶于水.实验室以NH
4Cl、盐酸、NaClO
2为原料制备ClO
2流程如下:
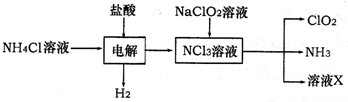
已知:电解过程中发生的反应为:
NH
4Cl+2HCl
NCl
3+3H
2↑;假设NCl
3中氮元素为+3价.
①写出电解时阴极的电极反应式______.
②在阳极上放电的物质(或离子)是______.
③除去ClO
2中的NH
3可选用的试剂是______(填序号)
A.生石灰B.碱石灰C.浓H
2SO
4D.水
④在生产过程中,每生成1molClO
2,需消耗______molNCl
3.
答案 : Ⅰ、①Fe
2O
3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ•mol
-1②CO(g)+1/2O
2(g)=CO
2(g)△H=bkJ•mol
-1③C(石墨)+O
2(g)=CO
2(g)△H=ckJ•mol
-1依据盖斯定律(③-②)×6-①×2得到4Fe(s)+3O
2(g)=2Fe
2O
3(s)△H=6(c-b)-2a kJ•mol
-1故答案为:6(c-b)-2a;
Ⅱ、(1)设计成原电池需要是自发进行的氧化还原反应;
A.C(s)+CO
2(g)=2CO(g)是非自发进行的氧化还原反应,故A不选;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H
2O(l),反应是复分解反应,不是氧化还原反应,故B不选;
C.2H
2O(l)=2H
2(g)+O
2(g),反应是非自发进行的氧化还原反应,故c不选;
D.CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(l),是自发进行的氧化还原反应,可以设计成原电池;故D选;
D反应是甲烷燃料电池,在碱溶液中甲烷燃料电池中燃料在负极发生氧化反应,氧气在正极得到电子发生还原反应;
负极电极反应为:CH
4-8e
-+10OH
-=CO
32-+7H
2O;
正极电极反应为:O
2+2H
2O+4e
-=4OH
-;
故答案为:D,CH
4-8e
-+10OH
-=CO
32-+7H
2O;O
2+2H
2O+4e
-=4OH
-;
(2)NH
4Cl+2HCl
NCl
3+3H
2↑;假设NCl
3中氮元素为+3价.
①电解时阴极上是氢离子得到电子生成氢气,阴极的电极反应式为:2H
++2e
-=H
2↑,故答案为:2H
++2e
-=H
2↑;
②电解时阳极上是铵根离子失去电子生成氢气,故答案为:NH
4Cl(NH
4+);
③A、ClO
2易溶于水,不能利用碳酸钠溶液吸收氨气,故A错误;
B、碱石灰不能吸收氨气,故B错误;
C、浓硫酸可以吸收氨气,且不影响ClO
2,故C正确;
D、ClO
2易溶于水,不能利用水吸收氨气,故D错误;
故选:C;
④NCl
3与NaClO
2恰好反应生成ClO
2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl
3+3H
2O+6ClO
-2=6ClO
2↑+3Cl
-+3OH
-+NH
3↑,生产过程中,每生成1mol ClO
2,需消耗
mol,故答案为:
.

点击加载更多评论>>