(16分)工业上可用煤制天然气,生产过程中有多种途径生成CH
4。
(1)写出CO
2与H
2反应生成CH
4和H
2O的热化学方程式
。
已知: ① CO(g)+H
2O(g)

H
2(g)+CO
2(g) ΔH=-41kJ·mol
-1 ② C(s)+2H
2(g)

CH
4(g) ΔH=-73kJ·mol
-1③ 2CO(g)

C(s)+CO
2(g) ΔH=-171kJ·mol
-1(2)另一生成CH
4的途径是CO(g)+3H
2(g)

CH
4(g)+H
2O(g)。其他条件相同时,H
2的平衡转化率在不同压强下随温度的变化如图所示。
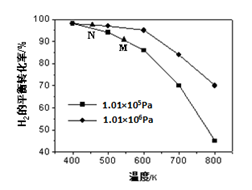
①该反应的△H
0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
③某温度下,将0.1 mol CO和0.3 mol H
2充入10L的密闭容器内发生反应CO(g)+3H
2(g)

CH
4(g)+H
2O(g),平衡时H
2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
答案 :
(1)CO
2(g)+4H
2(g)
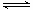
CH
4(g)+2H
2O(g) ΔH=-162kJ·mol
-1 (3分,热化学方程式2分,数据1分)
(2)①< (3分)
②相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高。 (3分)
③(7分)
CO(g)+3H
2(g)
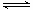
CH
4(g)+H
2O(g)
起始时各物质浓度/ mol·L
-1: 0.01 0 .03 0 0
平衡时各物质浓度/ mol·L
-1 0.002
0.006
0.008 0.008
(以上3分)
K=
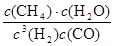
=
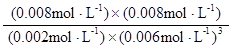
=0.148×10
6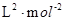
(1分) (1分) (2分,数据和单位各1分)
合成气(CO和H
2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H
2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe
2O
3(s)

3CO
2(g)+ 2Fe(s) △H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,
。
| A.容器中Fe2O3的质量不随时间而变化 |
B.反应物不再转化为生成物 |
| C.n (CO) :n (CO2) = 1:1 |
D.容器中气体的压强不随时间而变化 |
②在一个容积为4L的密闭容器中,1000℃时加入4mol CO(g)和足量Fe
2O
3(s),反应2分钟后达到平衡,测得此时容器内气体的密度为40g/L,求该时间范围内反应的平均反应速率υ(CO
2)= ___、CO的平衡转化率= _____、该反应的化学平衡常数K=
。
答案 :
(1)CH
4(g)+H
2O(g) =" CO" (g)+3H
2 (g) △H=+206kJ•mol
-1(2分)
(2)①A D(2分,少选、错选均为0分)
② 0.375 mol/(L•min)(2分)75% (1分) 27(2分)
 H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1  CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1 C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1 CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
 CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字) CH4(g)+2H2O(g) ΔH=-162kJ·mol-1 (3分,热化学方程式2分,数据1分)
CH4(g)+2H2O(g) ΔH=-162kJ·mol-1 (3分,热化学方程式2分,数据1分) CH4(g)+H2O(g)
CH4(g)+H2O(g)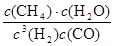 =
=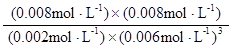 =0.148×106
=0.148×106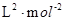
 3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0
点击加载更多评论>>