X、Y、Z、R、W五种元素分布在三个不同的短周期,它们的原子序数依次增大.YR
2是主要的温室气体,W是短周期中金属性最强的元素.甲是W的最高价氧化物的水化物,乙是X、Z组成的最简单化合物.
(1)Z元素在周期表中位于第2周期,第______族.
(2)甲含有的化学键有______.
(3)比较Y、R、W原子半径的大小:______<______<______.
(4)一定条件下,X单质和R单质在甲的浓溶液中可以形成燃料电池,该燃料电池的正极的反应式是______.
(5)工业上生产乙的适宜的反应条件是______和较高的温度;若每生成amol乙时放出bkJ热量,则该反应的热化学方程式为______.
(6)丙、丁、戊三种化合物都只由X、Y、R三种元素组成,在一定条件下有以下转化关系:

若戊是日常生活中常用的酸性调味品,则以上丙生成丁的化学方程式为:______.
答案 : YR
2是主要的温室气体,应为CO
2,则Y为C元素,R为O元素,Y、Z、R原子序数依次增大,则Z为N元素,W是短周期中金属性最强的元素,应为Na元素,X、Y、Z、R、W五种元素分布在三个不同的短周期,则X应为第一周期元素H,甲是W的最高价氧化物的水化物,应为NaOH,乙是X、Z组成的最简单化合物,应为NH
3,则
(1)Z为N元素,原子序数为7,原子核外有2个电子层,最外层电子数为5,位于周期表第二周期VA族,故答案为:VA;
(2)甲为NaOH,为离子化合物,含有离子键,NaOH中O-H为共价键,故答案为:离子键、共价键;
(3)O和C位于同一周期,C原子半径大于O,Na位于第三周期,比O、C多了一个电子层,原子半径最大,所以三者原子半径大小关系为:Na>C>O,故答案为:O、C、Na;
(4)碱性氢氧燃料电池中,氧气在正极发生还原反应生成OH
-,电极反应式为O
2+2H
2O+4e
-=4OH
-,故答案为:O
2+2H
2O+4e
-=4OH
-;
(5)工业合成氨在高温、高压、催化剂条件下进行,若每生成amolNH
3时放出bkJ热量,则生成1molNH
3放出
kJ的能量,所以合成氨的热化学方程式为N
2(g)+3H
2(g)

2NH
3(g)△H=-
kJ•mol
-1,
故答案为:合适的催化剂,高压;N
2(g)+3H
2(g)

2NH
3(g)△H=-
kJ•mol
-1;
(6)戊是日常生活中常用的酸性调味品,应为CH
3COOH,则丙为CH
3CH
2OH,丁为CH
3CHO,丙生成丁的反应为2CH
3CH
2OH+O
2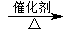
2CH
3CHO+2H
2O,
故答案为:2CH
3CH
2OH+O
2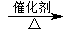
2CH
3CHO+2H
2O.
有A、B、C、D四种短周期元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A单质的还原性比B单质的还原性强,C的阴离子所带负电荷比D的阴离子所带负电荷多,则A、B、C、D的原子序数大小关系是( )
| A.B>A>C>D |
B.C>B>A>D |
C.A>B>C>D |
D.B>A>D>C |
答案 : 、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,则A、B元素的原子序数大于C、D元素的原子序数,
同周期元素从左到右元素的金属性逐渐减弱,对应的单质的还原性逐渐减弱,A单质的还原性比B单质的还原性强,则A的原子序数小于B,
同周期元素从左到右原子的最外层电子数逐渐增多,C的阴离子所带负电荷比D的阴离子所带负电荷多,则D的最外层电子数比C多,所以D的原子序数大于C,
所以四种元素的原子序数大小关系为B>A>D>C,
故选D.

 2NH3(g)△H=-
2NH3(g)△H=-
 2NH3(g)△H=-
2NH3(g)△H=-
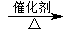 2CH3CHO+2H2O,
2CH3CHO+2H2O,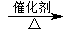 2CH3CHO+2H2O.
2CH3CHO+2H2O.
点击加载更多评论>>